موضوع بحث عن الهيدروجين بالمراجع،العنصر الكميائي الأكثر تواجداً فى الكون
advertisement

الهيدروجين (Hydrogen) هو عنصر كيميائي له الرمز H وله العدد الذرّي 1 ،ويتميز بأنه أخف الغازات وأكثرها تواجدا في الكون حيث يشكل 75% من حجم الكون،ويوجد في الماء وكل المركبات العضوية والكائنات الحية. ويتميز ببعض الخواص الفيزيائيه والكيميائية حيث انه غاز عديم اللون والرائحة، غير سام ،لا فلزي، وحيد التكافؤ، سريع الاشتعال، ثنائي الذرة.وموضعه فى الجدول الدوري ضمن المجموعة الاولى والسابعة لترابط العلاقات بينه وبين عناصر المجموعتين. لذا صعب على العلماء حصره فى مجموعة واحدة.
advertisement
تاريخ إكتشاف الهيدروجين
تكوّن الهيدروجين بعد فترة وجيزة جدّاً بعد الانفجار العظيم ولم تعلو درجة الحرارة بشكل كاف في أي مكان منذ ذلك الحين، أي أن كلّ الهيدروجين تشكّل فور تشكُّل الفضاء الكوني قبل ١٣ مليار سنة.(1)الهيدروجين من موسوعة المعرفة
advertisement
تم التعرف على الهيدروجين لأول مرة من قبل العالم البريطاني هنري كافنديش ، الذي أثبت للجمعية الملكية في لندن عام 1766 أن هناك نوعين مختلفين من الهواء: “الهواء الثابت” أو ثاني أكسيد الكربون – و “الهواء القابل للاشتعال” أو الهيدروجين، بعد أن طور غاز الهيدروجين عن طريق تفاعل معدن الزنك مع حمض الهيدروكلوريك.كما أظهر السيد كافنديش أيضًا أن الهيدروجين أخف بكثير من الهواء – وكان أول من أنتج الماء من الهيدروجين والأكسجين بمساعدة شرارة كهربائية.
كرر الكيميائي الفرنسي أنطوان لوران لافوازييه تجارب كافنديش،وبعد عدة محاولات ، نجح أيضًا في الجمع بين الهيدروجين والأكسجين لإنتاج الماء. واعتبرت تجارب لافوازييه التي أجريت عام 1785 أمام العديد من العلماء نهائية.
نجح العالم جيمس ديوار في تسييل غاز الهيدروجين في عام 1898 ، باستخدام آلة تبريد متجددة كبيرة قام ببنائها في المعهد الملكي. وواصل تحسين أساليبه ونجح في النهاية في خفض درجات الحرارة إلى 13 درجة فقط فوق الصفر المطلق ، وهي النقطة التي يسيل فيها كل غاز باستثناء الهيليوم.وفي العام التالي تمكن العالم ديوار من تحضير الهيدروجين الصلب.(2)مقالة بعنوان / This Month in Physics History January 19, 1894: James Dewar produces solid air من موقع –www.aps.org
تسميته
advertisement
في عام 1783، قام العالم أنطوان لافوازييه بمنح العنصر المكتشف اسم الهيدروجين، وذلك باشتقاق التسمية من الإغريقيّة، حيث أن لفظة هيدرو ὕδρω تعني ماء ولفظة جين γενῆς تعني مكوّن أو مولّد أو مشكّل، وذلك عندما قام هو وبيير لابلاس بإعادة تجربة كافنديش بتشكيل الماء عند حرق الهيدروجين.
أول استخدام لغاز الهيدروجين
كان نفخ المناطيد من أوّل استخدامات الهيدروجين، وكان جاك شارل أوّل من قام بهذا العمل وذلك عام 1783. وبناء على هذه الفكرة قام الكونت الألماني فرديناند فون زبلين بتسويق فكرة المناطيد المزوّدة بالهيدروجين، حيث أسّس لاحقاً شركة متخصّصة بهذا الشأن أسماها على اسمه مناطيد زبلين، والتي كانت الرحلة الأولى لها عام 1900.بعد عشر رحلات جوية ناجحة عبر المحيط الأطلسي من ألمانيا إلى الولايات المتحدة ، تحطمت هيندنبورغ ، وهي طائرة محمولة منفوخة بغاز الهيدروجين ، عند هبوطها في ليكوود ، نيو جيرسي.
تم حل لغز الاصطدام في عام 1997. وخلصت دراسة إلى أن الانفجار لم يكن بسبب غاز الهيدروجين ، ولكن بسبب تفريغ كهربائي ثابت مرتبط بالطقس أدى إلى إشعال الغطاء الخارجي المصنوع من قماش القنب.(3)مقالة بعنوان /THE HISTORY OF HYDROGEN من موقع –altenergymag.com
advertisement
استخدامه كوقود
نما الاهتمام العملي بالهيدروجين كوقود في أوروبا بعد الحرب العالمية الأولى، كما دفعت الحرب العالمية الثانية البحث عن وقود الهيدروجين إلى أبعد ما يمكن .
وجود الهيدروجين

يُعد الهيدروجين أكثر العناصر توافرًا في الكون. حيث نجد تقريبًا في كل عشر ذرات في الكون تسع ذرات هيدروجين. ويُعد الهيدروجين عنصر شائع على الأرض أيضًا. فهو ثالث العناصر توافرًا بعد الأكسجين والسيليكون. حيث أن حوالي 15% من الذرات التي وجِدت على الأرض هي ذرات هيدروجين.(4)مقالة بعنوان /الهيدروجين Hydrogen من موقع –arabian-chemistry.com
وجوده فى النجوم
advertisement
يوجد عنصر Hydrogen بكميّات كبيرة في النجوم والعماليق الغازيّة، كما تلعب السحب الجزيئيّة للهيدروجين H2 دوراً في ولادة النجوم وفي تزويدها بالوقود اللازم ،حث انه في النجوم تندمج ذرات الهيدروجين لتكون الهيليوم وهو ثاني أكثر عنصر انتشارًا في العالم، يحتوي الهيليوم على بروتونين اثنين، نيوترونين اثنين والكترونين اثنين، يشكل الـ (Hydrogen) والهيليوم معًا نسبة 99.9% من المادة المقاسة في الكون.
وجوده خارج الانظمة النجمية
يتوافر (H) خارج الأنظمة النجميّة على شكل سحب غازيّة، وذلك في مناطق الهيدروجين I (هي إحدى السحب الكونية في الوسط بين النجمي تتكون من ذرات الهيدروجين المتعادلة) حيث يوجد على شكل ذرّي معتدل غير متأيّن. هذه المناطق تصدر إشعاعاً له تردّد 1420 ميغا هرتز، والذي يسمّى خط هيدروجين. هذا الإشعاع يمكّن من تحديد مواقع تركّز الهيدروجين في الكون.
وجوده على سطح الارض
يتواجد الهيدروجين على سطح الأرض بشكل رئيسي على هيئة الماء. كل جزيء من الماء يحتوي على ذرتين من الهيدروجين وذرة أكسجين. وُجِد الهيدروجين أيضًا في العديد من الصخور والمعادن. يُقدر توافره بحوالي 1500 جزء من المليون. مما يجعل الهيدروجين عاشر العناصر توافرًا في القشرة الأرضية.
وجوده فى الاحياء
ينتج غاز الهيدروجين طبيعيّاً من بعض البكتريا والطحالب.كما انه يوجد بوفرة كبيرة على سطح الأرض وذلك عندما يرتبط على شكل مركّبات كيميائيّة مثل الهيدروكربونات والماء، حيث يعدّ بذلك ثالث أكثر العناصر وفرةً على سطح الأرض وذلك بعد الأكسجين والسيليكون. إنّ أكثر من نصف المعادن المكتشفة لحدّ الآن تحوي في تركيبها على الهيدروجين.
فى جسم الانسان
يوجد الهيدروجين في جسم الإنسان والثديّات الأخرى على شكل مركّبات كيميائيّة حيويّة كالماء والسكريات (الكربوهيدرات). يحتلّ الهيدروجين المرتبة الثالثة من حيث ترتيب العناصر الموجودة في جسم الإنسان وذلك بالنسبة للكتلة. على سبيل المثال بالنسبة لإنسان يزن 70 كيلوغرام فإنّ حوالي 10% منه (أي 7 كغ) عبارة عن هيدروجين. فقط الأكسجين (حوالي 63% من الوزن) والكربون (حوالي 20% من الوزن) يفوقان الهيدروجين في هذا الترتيب. إذا قمنا بترتيب العناصر في جسم الإنسان بالنسبة لعددها، فإنّ الهيدروجين بذلك يحتلّ صدارة القائمة (عدد الذرّات الموجودة في 7 كغ في جسم الإنسان توافق 3.5×103 مول أي 4.2×1027 ذرة هيدروجين).
موضعه فى الجدول الدوري
يمكن وضع الهيدروجين فى المجموعة الاولى او المجموعة السابعة وذالك لوجود بعض العلاقات التى تربط الهيدروجين بفلزات المجموعة الاولى وهالوجينات المجموعة السابعة.
ارتباطه بعناصر المجموعة الاولى:
- يحتوي كلاً من الهيدروجين وعناصر المجموعة الاولى على الكترون واحد من الكترونات التكافؤ التي في الغلاف الاخير.
- يمكن ان يكون ايون موجب بفقد الالكترون مثل فلزات الاقلاء .
ارتباطه بعناصر المجموعة السابعة :
- ان الهيدروجين لافلز مثل الهالوجينات ويكون جزيئاته ثنائية الذرة كما في الهالوجينات .
- يمكن ان يكون ايون سالب عن طريق اكتساب الكترون مثل الهالوجينات .
طرق تحضيره
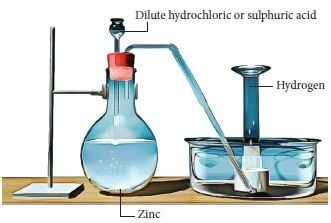
هناك اربع طرق رئيسية لتحضير الهيدروجين .كما يمكن ايضاً تحضيره بطريقة فرانك وبوش .
أولاً تحضير الهيدروجين من مركباته المحتويه على ايونات الهيدروجين الموجبة:
1- بتفاعل الفلزات مع الماء :
| 2Na+2HOH→2NaOH+H2 |
2- بتفاعل الفلزات مع الاحماض المخففة:
| Zn+2HCl→ZnCl2 +H2 |
3- بتفاعل الفلزات مع القلويات :
| Zn+2NaOH →Na2 ZnO2 +H2 |
ثانياً تحضير الهيدروجين من التحليل الكهربي للماء :
advertisement
| 1- –Ba(OH)2 ↔ Ba++ +2OH |
| 2- Ba2+ + 2H2 O ↔ Ba(OH)2 +H2 |
| 3- 4OH– ↔ 2H2 O + O2 |
ثالثاً تحضير الهيدروجين من الهيدريدات:
| Na+ H– + H2 O ↔ NaOH + H2 |
رابعاً بالتفكك الحراري لجزيئات بعض مركبات الهيدروجين :
| 4H2 O + 3Fe ↔ Fe3 O4 +4H2 |
ذرة الهيدروجين
يشكل الهيدروجين الذري حوالي 75٪ من الكتلة الأولية للكون،حيث أن ذرات الهيدروجين شديدة التفاعل لدرجة أنها تتحد مع جميع العناصر تقريبًا.
تتكون ذرة الهيدروجين من نواة تضم بروتون واحد كتلته: mp = 1,672 65.10-27 كغ ذو شحنة qp=+e و من إلكترون كتلته: me = 9,109 53.10-31 كغ ذو شحنة qe = – e ،مع “e” هي الشحنة الابتدائية e = 1,602 189.10-19 C .البروتون والإلكترون هم فرميونات، اللف المغزلي لكل منهما هو s=1/2. و هما يعتبران جسم نقطي.
الصور المختلفة للهيدروجين
1- الهيدروجين حديث التولد : ويمتاز الهيدروجين حديث التولد( حديث التحضير) بنشاطه الكيميائي الكبير ،حيث انه اذا تم امرار غاز الهيدروجين العادي فى محلول لحمض كلوريد الحديديك فانه سيظل دون اختزال، اما اذا اضيف للمحلول هيدروجين حديث التحضر فان كلوريد الحديديك سوف يختزل الى حديدوز طبقاً للمعادلة :
| FeCl2 + H ↔ FeCl2 +HCl |
2- الهيدروجين الذري : حيث يمكن أن تتفكك جزيئات الهيدروجين الى ذرات ،ولكن ذالك يحتاج الى طاقة كبيرة للتغلب على قوة الترابط بين الذرتين ،حسب المعادلة :
| H2 ↔2H ΔH = 100K.cal |
3- الهيدروجين الأرثو والبارا : يتكون الهيدروجين العادي من شكلين مختلفين فى طاقة حركاتهما الدورانية ،وقد سمي احدهما بالهيدروجين البارا والاخر بالهيدروجين الارثو ،وهما متشابهين فى الخواص الكيميائية ويختلفان فى حرارتهما النوعية وفي بعض الخواص الطبيعية الاخرى .
ويختلف النوعين فى طريقة دوران نواتا الذرتين فى الجزئ .ففي الهيدروجين الأرثو النواتان تدوران فى اتجاه واحد، بينما فى الهيدروجين البارا تدور النواتان فى اتجاهين متضادين .كما يحتوي الهيدروجين العادي على 75% من كميته ارثو و25% من البارا.
4- ايون الهيدروجين الموجب ( +H ) : يمكن الحصول على ايون الهيدروجين الموجب (البروتون) ،من اذابة بعض مركبات الهيدروجين فى الماء مثل الأحماض .ويوجد ايون الهيدروجين الموجب ( +H ) في الماء في صورة هيدرونيوم أيون ( +H3 O ) .
5- ايون الهيدروجين السالب ( –H ) : يتكون هذا الأيون عندما تكتسب الذرة الكتروناً من ذرة أخرى ،ولا يتم ذالك بسهولة اذ أن الطاقة المنطلقة فى هذا التفاعل ضئيلة جدا اذا قورنت بالهالوجينات ،ولذالك فلا يتكون هذا الأيون الا اذا تفاعل الهيدروجين بفلزات المجموعة الإولى والثانية مثل :
| –Na + 0.5H2 ↔ Na+ H |
نظائر الهيدروجين
لدى الهيدروجين (H) ثلاث نظائر متوفرة طبيعياً وهي H3 و H2 و H1 . أكثر نظير مشع ثابت للهيدروجين هو H3 وله عمر نصف مقداره 12.32 سنة. هنالك نظائر أخرى أثقل (H4 إلى H7)ولكنها غير ثابتة بالمرة (عمر النصف لها أقل من زبتو ثانية (10−21 من الثانية) ومصنعة فقط مخبرياً. من هذه النظائر الثقيلة، يعد H5 أكثرها ثباتاً، أما أقلها فهو H7.
يعد الهيدروجين العنصر الكيميائي الوحيد الذي تختلف أسماء نظائره، حيث أن نظائر العناصر الأخرى تتميز عن بعضها بعدد الكتلة الموافق. يسمّى النظير هيدروجين-2 ديوتيريوم(D)، في حين أن النظير هيدروجين-3 يسمّى تريتيوم(T). النظير الشائع للهيدروجين وهو هيدروجين-1، والذي لا يحوي نيوترونات، يدعى بروتيوم(H).(5)مقالة بعنوان / نظائر الهيدروجين من –ويكيبيديا
والثلاث نظائر متشابهة فى العدد الذري ومختلفة فى الوزن الذري .فنواة ذرة الهيدروجين العادي تحتوي على بروتون فقط، اما نواة الديوتيريم تحتوي على بروتون ونيوترون ،ونواة التريتيوم تحتوي على بروتون واثنين نيترون.
الخواص الكيميائيه للهيدروجين
1- الاحتراق : يحترق الهيدروجين في جو من الأكسجين مكونًا بخار الماء ،وهذا التفاعل طارد للحرارة ،طبقاً للمعادلة :
| 2H2 + O2 → 2H2 O ΔH = -57.85 |
2- التفاعل مع الهالوجينات : يتفاعل الهيدروجين معلى الهالوجينات ويقل ميل هذا التفاعل من الفلور الى اليود .حيث ان التفاعل مع الفلور يكون مصحوباً بانفجار، أما في حالة الكلور فيكون مصحوباً باشتعال أما في حالتي البروم واليود فأن التفاعل عكسي.
|
H2 + X2 → 2HX [ X = F,Cl,Br,I ]
|
3- التفاعل مع النيتروجين : يتفاعل الهيدروجين مع النيتروجين لتكوين النشادر ،وذالك فى وجود عامل حفاز تحت ضغط مرتفع (200 جو) ودرجة حرارة 500 .
| N2 + 3H2 ↔ 2NH3 ΔH =-22.1K.cal |
4- التفاعل مع المركبات العضوية غير المشبعة : يتفاعل الهيدروجين تحت ظروف خاصة مع المركبات العضوية غير المشبعة كالاليفينات والاسيتيلينات والزيوت النباتية ،وتعرف هذه العمليه الاخيرة بهدرجة الزيوت وتحول فيها الزيوت الى دهنيات ،حيث يمرر الهيدروجين على الزيوت تحت ضغط 5 جو ودرجة حرارة 200 درجة فى وجود فلز النيكل المجزأ كعامل حفاز .
الإندماج النووي
عن طريق الاندماج النووي تستمدّ الشمس حرارتها وكذلك النجوم. في هذا التفاعل تندمج ذرّات الهيدروجين في درجة حرارة نحو 12 مليون درجة مئويّة وضغط عالي جداً فيتكوّن الهيليوم. يقوم النجم بذلك التفاعل أثناء 90% من عمره، بعد ذلك يكون الجزء الأكبر من الهيدروجين قد استهلك وتحوّل إلى هيليوم.
يمكن سريان التفاعل الاندماجي بطريقتين، وبواسطتهما يلتحم 4 بروتونات وهي أنوية الهيدروجين فتتكوّن نواة الهيليوم 4He عن طريق:
- الالتحام المباشر في تفاعل بروتون-بروتون المتسلسل.
- دورة كربون-نيتروجين-أكسجين (دورة CNO) والتي تلعب العناصر الثقيلة كربون ونيتروجين وأكسجين دوراً فيها.
وعند حساب الطاقة الناتجة فيجب الأخذ في الحسبان تولّد اثنين من البوزيترونات في كلّ تفاعل يؤدي إلى هيليوم-4 سواء في تفاعل البروتون-بروتون أو في دورة CNO.
يتفاعل كل بوزيترون مع أحد الإلكترونات في الحال عن طريق إفناء إلكترون-بوزيترون وينتجا طاقة إضافيّة قدرها 1.022 ميغا إلكترون فولت. أي أنّه يلزم لحساب الطاقة الناتجة حساب نقص الكتلة للأربعة بروتونات التي التحمت مكوّنة نواة الهيليوم بالإضافة إلى ضعف كتلة الإلكترون. ونقص الكتلة هو الفرق في كتلة المواد الداخلة في التفاعل وهي كتلة أربعة ذرات الهيدروجين (وهي تتكون من 4 بروتونات وأربعة إلكترونات) وطرح كتلة ذرّة الهليوم 4He. كما ينتج عن ذلك أيضا نيوترينو يأخذ جزءاً من الطاقة ويغادر بها الشمس أو النجم.
انظر ايضاً : الانشطار النووي وصناعة القنابل النووية والذرية
وعن طريق الاندماج النووي يفقد الهيدروجين الداخل في التفاعل نحو 0.73% من كتلته تتحوّل إلى طاقة، وتلك ما يسمّى نقص الكتلة. ويمكن حساب الطاقة الناتجة عن ذلك النقص في الكتلة عن طريق المعادلة الشهيرة لأينشتاين وهي معادلة تكافؤ المادة والطاقة: E = mc² حيث m الكتلة و c سرعة الضوء في الفراغ.
يعتبر الاندماج النووي بين الهيدروجين لإنتاج الهيليوم أكثر التفاعلات النوويّة إنتاجاً للطاقة من بين التفاعلات النوويّة الأخرى.
الخواص الفيزيائية
يعتبر الهيدروجين غازًا ثنائي الذرة غير سام وغير معدني وايضاً هو غاز عديم اللون والرائحة والطعم. له كثافة هي الأقل بين جميع العناصر الكيميائية 0.08999 جم/لتر. مقارنةً بكثافة الهواء التي تبلغ 1.29جم/لتر فإن كثافة الهواء تزيد بمقدار 14 مرة عن كثافة الهيدروجين.
يتحول من الحالة الغازية إلى الحالة السائلة عند درجة حرارة -252.77 درجة مئوية أو -422.99 درجة فهرنهايت، ويتحول إلى الحالة الصلبة عند درجة حرارة -259.2 درجة مئوية أو -434.6 درجة فهرنهايت. كما انه يذوب بدرجة قليلة في الماء والكحولات والقليل من السوائل الشائعة.(6)مقالة بعنوان /Properties of Hydrogen من موقع –courses.lumenlearning.com
استخداماته
- تحضير الأمونيات وبالتالي صناعة الأسمدة.
- هدرجة الزيوت وتحويلها الى السمن الصناعي .
- هدرجة الفحم في وجود عامل مساعد مثل اكسيد الحديديك مع الأمونيا فى وجود قليل من اكسيد التيتانيوم حيث يتحول جزء من الفحم الى زيوت خفيفة يمكن الحصول منها على الجازولين وزيوت التشحيم .
- انتاج الكحول الميثيلي عن طريق تفاعله مع اول اكسيد الكربون في وجود عامل مساعد .
- يستخدم كوقود فى حالة استخدام قوس الهيدروجين الذري المستعمل فى لحام المعادن .
- يستخدم كعامل مختزل فى عمليات الانتاج التجاري لبعض الفلزات .
المصادر والمراجع
advertisement









